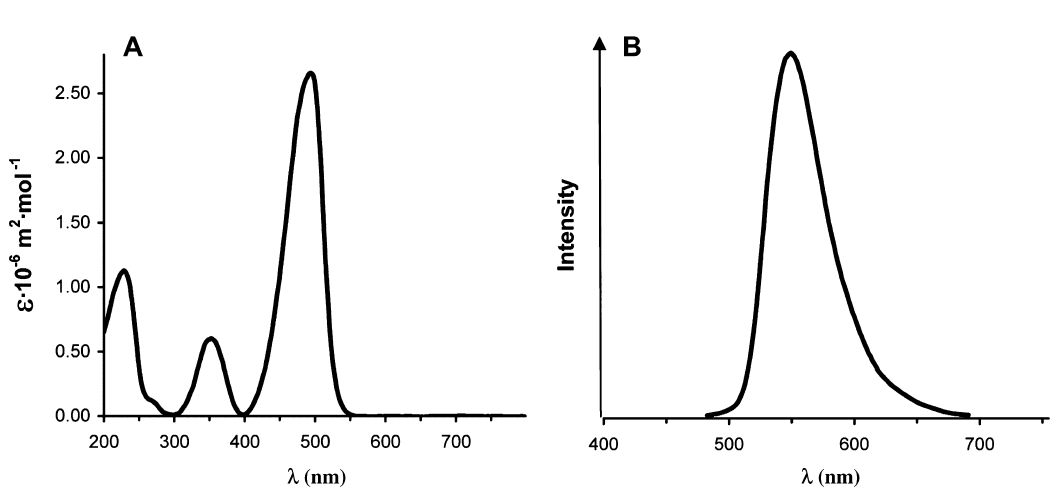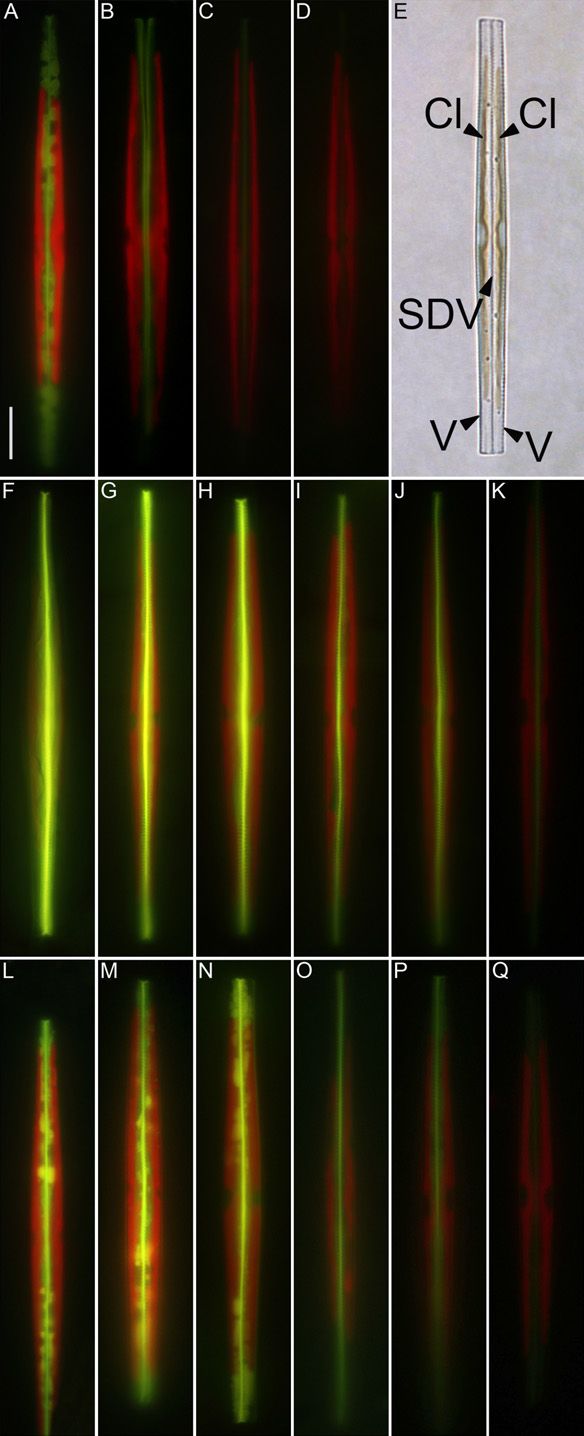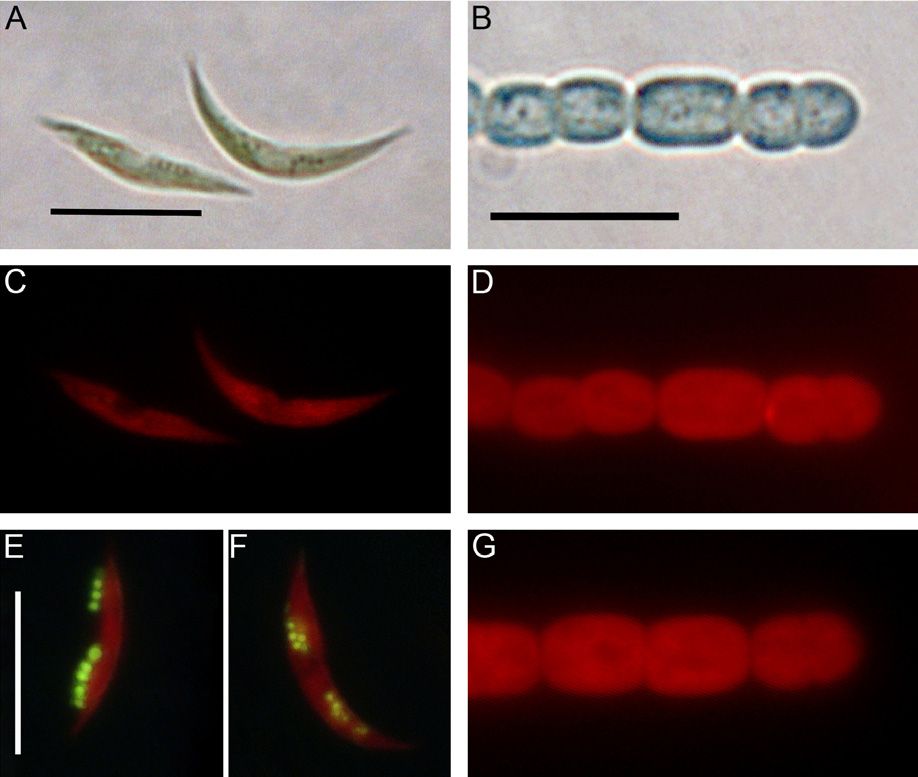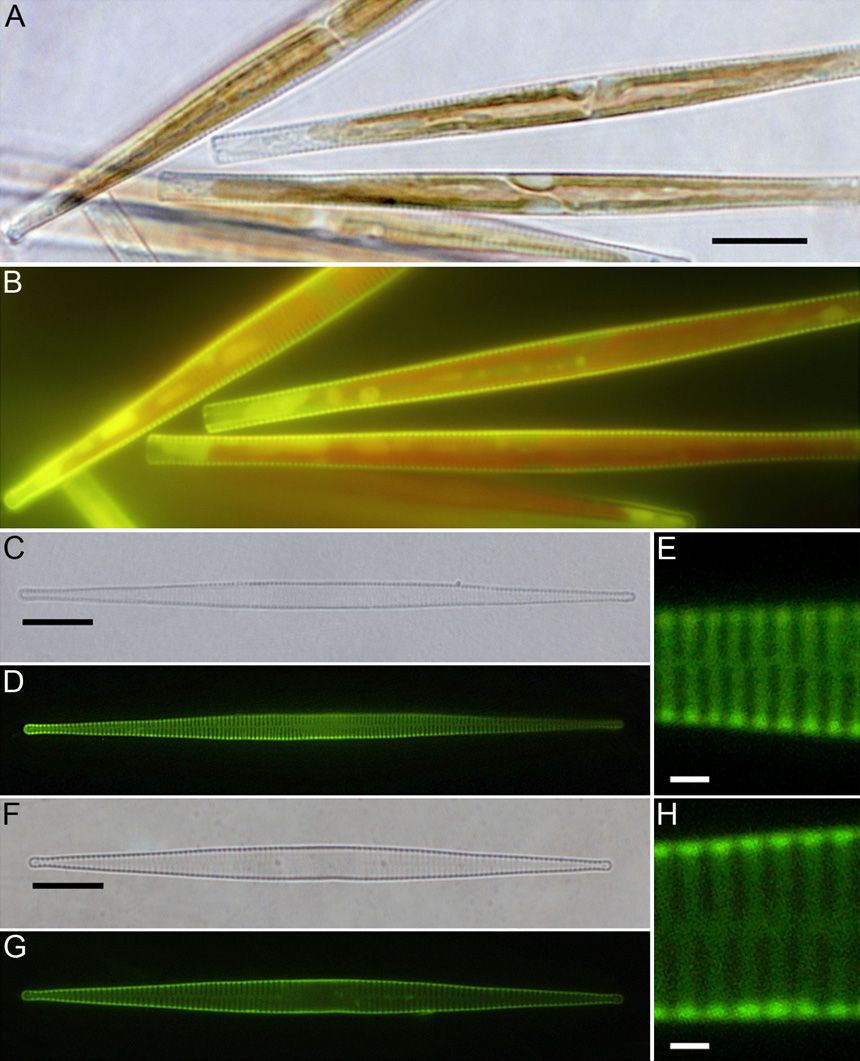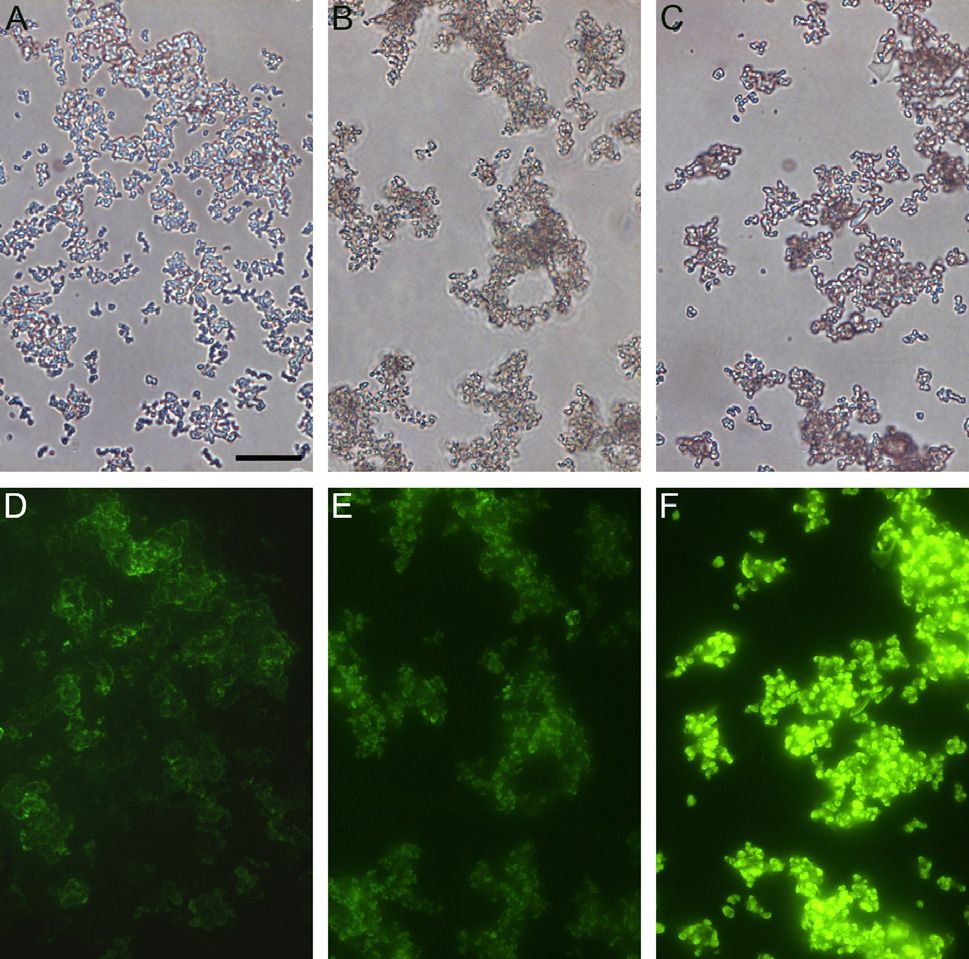
Слабоосновные флуоресцентные красители используют для того, чтобы визуализировать органеллы в живых клетках благодаря их сродству с кислыми субклеточными органеллами. В частности, их используют чтобы окрашивать кремнезём, откладываемый в везикулах отложения кремнезёма (SDVs) диатомей в ходе синтеза их панциря. Настоящее исследование включило в себя синтез флуоресцентных красителей, получаемых из олигопропиламинов, соединений сходных с веществами, обнаруженными в диатомеях. Эти красители получены реакцией олигопропиламинов с 4-хлор-7-нитробензо-2-окса-1,3-диазолом. Реакция проводилась с использованием метилированных олигопропиламинов, содержащих два или три атома азота с получением двух новых флуоресцентных красителей: NBD-N2 и NBD-N3. Оказалось, что эти красители проявляют высокую эффективность в прижизненном окрашивании растущих кремнистых панцирей диатомей при концентрациях, по крайней мере, в 10 раз более низких, чем концентрации, требующиеся для окрашивания красителем HCK-123. NBD-N3 также эффективно окрашивал другие субклеточные везикулы эукариотических одноклеточных водорослей. NBD-N2 окрашивал только растущие диатомовые панцири, тогда как NBD-N3 также окрашивал различные субклеточные органеллы различных эукариотических одноклеточных водорослей. NBD-N2 и NBD-N3 не удалялись из окрашенных панцирей диатомей жёсткими обработками при помощи H2SO4 и H2O2. Флуоресцентный кремнезём можно также получить его химическим осаждением в присутствии NBD-N2 и NBD-N3.